تلفست یا فکسوفنادین؛ داروی ضد آلرژی که علائم را سریع کم میکند!

یکی از داروهای پرکاربرد در کنترل و کاهش علائم آلرژی، فکسوفنادین است. این دارو با نامهای تجاری مختلفی مانند تلفست(Telfast) و فکسوکیم(Fexokim) در داروخانهها عرضه میشود. قرص تلفست میتواند بهطور مؤثر علائمی مانند عطسه، سرفه، خارش و آبریزش بینی را کاهش دهد و به بهبود نشانههای تب یونجه و کهیر مزمن کمک کند.
به همین دلیل، مصرف این دارو در کودکان و بزرگسالان باعث تسکین علائم آزاردهنده آلرژی فصلی و افزایش کیفیت زندگی بیماران میشود. البته مانند بسیاری از داروهای ضدحساسیت، در برخی افراد ممکن است عوارضی نظیر حالت تهوع، ناراحتیهای گوارشی، تورم لبها یا زبان و در مواردی خوابآلودگی خفیف مشاهده شود.
در این مقاله از مجله علمی شیمی داکس قصد داریم با نگاهی دقیق و علمی، با این دارو، نحوه عملکرد و موارد مصرف آن آشنا بشویم و خوشحال می شویم اگر پرسشی درباره مزایا، نحوه مصرف یا عوارض جانبی فکسوفنادین دارید، آن را در بخش نظرات مطرح کنید تا کارشناسان شیمی داکس به آن پاسخ بدهند.
آلرژی یا حساسیت چیست؟
اجازه بدهید قبل از اینکه به معرفی و بررسی فکسوفنادین بپردازیم، ابتدا به این پرسش پاسخ دهیم که آلرژی چیست؟ آلرژی در واقع واکنش بیشازحد سیستم ایمنی بدن نسبت به موادی است که معمولاً برای بیشتر افراد بیضرر هستند؛ موادی مانند گردوغبار، گرده گلها، موی حیوانات یا برخی غذاها.
سیستم ایمنی در مواجهه با این مواد، به اشتباه آنها را تهدید تلقی میکند و موادی مانند هیستامین ترشح میکند که باعث بروز علائمی مثل عطسه، خارش، آبریزش بینی و قرمزی چشمها میشود. داروهایی مانند فکسوفنادین با مهار اثر هیستامین در بدن، به کاهش این علائم کمک میکنند و فرد احساس آرامش و راحتی بیشتری پیدا میکند.
داروی فکسوفنادین یا تلفست چیست؟
به گزارش وبسایت معتبر Drugs، داروی فکسوفنادین(Fexofenadine) یکی از آنتیهیستامینهای نسل دوم است که برای کاهش علائم آلرژی و درمان واکنشهای حساسیتی به کار میرود. این دارو معمولاً برای کنترل نشانههایی مانند عطسه، آبریزش یا گرفتگی بینی، خارش و قرمزی چشم، کهیر و خارش پوستی تجویز میشود.
مکانیسم اثر فکسوفنادین بر پایه مهار گیرندههای H1 هیستامینی در بدن است. در واقع، این دارو با مسدود کردن عملکرد هیستامین از بروز علائم ناخوشایند آلرژیک جلوگیری میکند.
| نام ژنریک | فکسوفنادین |
|---|---|
| نام(های) تجاری | تلفست (Telfast)، فکسوکیم، فکسوفست و سایر برندها |
| موارد مصرف | درمان علائم آلرژی فصلی، تب یونجه، کهیر مزمن، خارش پوستی، عطسه و آبریزش بینی |
| اشکال دارویی | قرص خوراکی، شربت (برای کودکان)، قرص جویدنی یا محلول سریع در دهان |
| دوز رایج | بزرگسالان: ۱۲۰ تا ۱۸۰ میلیگرم در روز | کودکان: بر اساس سن و وزن طبق تجویز پزشک |
| هشدارها و نکات | احتیاط در بیماران کلیوی، پرهیز از مصرف همزمان با آب گریپفروت، احتمال تهوع یا خوابآلودگی خفیف، مشورت با پزشک در صورت مصرف داروهای دیگر |
پیش از مصرف این دارو، لازم است سابقه پزشکی خود را با پزشک در میان بگذارید. افرادی که دچار نارسایی یا بیماریهای کلیوی هستند، باید با احتیاط و تحت نظر پزشک از این دارو استفاده کنند. همچنین در صورت وجود حساسیت یا واکنش آلرژیک به سایر آنتیهیستامینها، پزشک ممکن است داروهای جایگزین را تجویز کند.
قرص یا شربت تلفست، به طور معمول برای درمان خارش پوست ناشی از کهیر ایدیوپاتیک مزمن در بزرگسالان و کودکان بالای 6 سال استفاده میشود.
اگر برای شما بعد خواندن این متن سوال شده که هیستامین چیست؟ باید بگم که هیستامین مادهای که هنگام بروز آلرژی از سلولهای بدن آزاد میشود.
نام تجاری داروی فکسوفنادین چیست و چه اَشکال دارویی دیگری دارد؟
داروی فکسوفنادین (Fexofenadine) با چند نام تجاری مختلف در بازار دارویی شناخته میشود که معروفترین آنها تلفست (Telfast) است. علاوه بر تلفست، این دارو ممکن است با نامهای دیگری مانند فکسوکیم (Fexokim)، فکسوفست یا آلرگونیکس نیز عرضه شود. تفاوت میان این برندها معمولاً در شرکت تولیدکننده، قیمت و فرمولاسیون دارویی است، اما ماده مؤثرهی اصلی در همۀ آنها یکی است.
از نظر اَشکال دارویی، فکسوفنادین در چند نوع فرم تولید و عرضه میشود تا بیماران بتوانند بر اساس سن و شرایط خود از مناسبترین گزینه استفاده کنند:
- قرصهای خوراکی که رایجترین شکل مصرف در بزرگسالان است.
- شربت خوراکی که بیشتر برای کودکان یا افرادی که بلع قرص برایشان دشوار است، تجویز میشود.
- قرصهای جویدنی یا محلول سریع در دهان در برخی برندها برای سهولت مصرف در کودکان و نوجوانان موجود است.
آنتیهیستامین چند نسل دارد؟
گفتیم که فکسوفنادین از دستهی آنتی هیستامینهای نسل دوم است. حالا شاید برای شما این سؤال پیش آمده باشد که اصلاً آنتیهیستامینها چند نسل دارند و تفاوت آنها در چیست؟ بهطور کلی، داروهای آنتیهیستامین به دو نسل اصلی تقسیم میشوند:
آنتیهیستامینهای نسل اول
این داروها مانند دیفنهیدرامین(Benadryl) و کلرفنیرامین جزو اولین ترکیبات ضدحساسیت هستند. آنها بهراحتی وارد مغز میشوند و به همین دلیل معمولاً باعث خوابآلودگی، کاهش تمرکز و کندی واکنشها میشوند. به همین خاطر، مصرفشان هنگام رانندگی یا کارهای دقیق توصیه نمیشود.
آنتیهیستامینهای نسل دوم
این گروه جدیدتر است و از نظر ساختار شیمیایی طوری طراحی شده که کمتر وارد سیستم عصبی مرکزی شود. داروهایی مثل فکسوفنادین(تلفست)، لوراتادین و سیتریزین در این دسته قرار دارند. ویژگی مهم آنها این است که خوابآلودگی بسیار کمتری ایجاد میکنند و اثرشان برای مدت طولانیتری باقی میماند.
در برخی منابع، از داروهای جدیدتری با عنوان نسل سوم آنتیهیستامینها نیز یاد میشود که معمولاً همان ترکیبات اصلاحشدهی نسل دوم هستند با عوارض کمتر و پایداری بیشتر، مثل لووستیریزین یا دسلوراتادین.
دوزهای مختلف فکسوفنادین و مقدار مصرف
فکسوفنادین یا تلفست معمولا در 4 دوز مختلف، تولید میشود:
- فکسوفنادین 60 میل؛ دو بار در روز و عموماً برای علائم خفیف آلرژی تجویز میشود.
- فکسوفنادین 120 میل؛ یک بار در روز و معمولاً برای تسکین علائم آلرژی فصلی تجویز میشود.
- فکسوفنادین 180 میل؛ معمولا یک بار در روز و برای کنترل کهیر مزمن و علائم آلرژی سنگین تجویز میشود.
- فکسوفنادین 120 میل؛ در شرایط خاص و تحت نظر پزشک تجویز میشود.
اگر یک دوز مصرف فکسوفنادین را فراموش کردیم، چه کنیم؟
اگر یک نوبت از مصرف فکسوفنادین را فراموش کردید، بهترین کار این است که به محض یادآوری، آن را مصرف کنید. با این حال، اگر زمان نوبت بعدی نزدیک است، تنها دوز فراموششده را مصرف کنید و از خوردن دو دوز همزمان خودداری کنید تا از بروز عوارض احتمالی جلوگیری شود.
نکات مهم در مصرف قرص تلفست
حتماً توجه کنید که برای تغییر دوز دارو یا جایگزینی آن با داروی دیگر، حتماً با پزشک مشورت کنید. همچنین رعایت زمانبندی دقیق مصرف دارو طبق دستور پزشک اهمیت زیادی دارد تا اثربخشی تلفست در کنترل علائمی مانند آبریزش بینی، عطسه و خارش چشم حفظ شود.
موارد مصرف تلفست
در ادامه چند مورد مصرف اصلی تلفست یا فکسوفنادین را برای شما آماده کردیم.
1. تب یونجه (رینیت آلرژیک فصلی)
تلفست میتواند علائم آزاردهنده تب یونجه مانند عطسه، آبریزش بینی، خارش و قرمزی چشمها را کاهش دهد. این دارو با مهار اثر هیستامین در بدن، التهاب و حساسیت مخاط بینی و چشم را کنترل میکند و به بیماران کمک میکند روزمرگی خود را بدون ناراحتی ادامه دهند.
2. کهیر مزمن (Urticaria)
در افراد مبتلا به کهیر مزمن ناشی از واکنشهای آلرژیک پوستی، فکسوفنادین با کاهش ترشح هیستامین و جلوگیری از تحریک پوست، باعث کاهش خارش، قرمزی و تورم میشود. این دارو معمولاً برای تسکین علائم طولانیمدت کهیر کاربرد دارد و کیفیت زندگی بیماران را بهبود میبخشد.
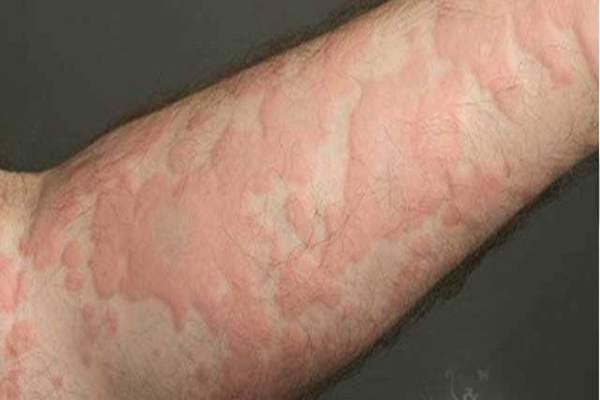
3. علائم آلرژی فصلی در بینی و چشم
آبریزش بینی، گرفتگی بینی، عطسه و خارش چشمها از شایعترین نشانههای حساسیت فصلی هستند. تلفست با مهار فعالیت هیستامین، باعث کاهش این علائم شده و به فرد اجازه میدهد بدون ناراحتی به فعالیتهای روزمره خود ادامه دهد.
قرص تلفست برای سرفه
یکی از علائم شایع واکنشهای آلرژیک فصلی یا ناشی از حساسیتهای محیطی، سرفه خشک و مداوم است. این سرفه معمولاً ناشی از تحریک مخاط حلق و بینی توسط هیستامین است که باعث التهاب و واکنشهای حساسیتی میشود.
فکسوفنادین با مهار اثر هیستامین در بدن، نه تنها علائم بینی و چشم را کاهش میدهد، بلکه میتواند سرفه ناشی از آلرژی را نیز تسکین دهد. با مصرف این دارو، التهاب و تحریک مخاط تنفسی کمتر شده و دفعات سرفه کاهش مییابد، در نتیجه فرد احساس راحتی بیشتری پیدا میکند.
با این حال، مهم است بدانید که تلفست برای سرفههای ناشی از سرماخوردگی یا عفونتهای ویروسی کاربرد ندارد و تنها برای سرفهای مؤثر است که ریشه آلرژیک دارد.
4. حساسیت به گرد و غبار یا موی حیوانات
افرادی که به گرد و غبار خانگی، قارچها یا موی حیوانات خانگی حساسیت دارند، معمولاً با تماس یا استنشاق این عوامل دچار علائم آلرژیک میشوند. فکسوفنادین با جلوگیری از بروز واکنش هیستامینی، به کاهش خارش پوست، عطسه و آبریزش بینی کمک میکند و علائم آلرژی را کنترل میکند.
اثربخشی و آمار تلفست
مطالعات بالینی نشان دادهاند که مصرف تلفست باعث بهبود چشمگیر علائم آلرژیک در حدود ۷۰ تا ۸۰ درصد بیماران میشود. این دارو در مقایسه با آنتیهیستامینهای نسل اول، اثر درمانی مشابهی دارد، اما خوابآلودگی و اثرات جانبی آن بهمراتب کمتر است، بنابراین برای استفاده روزمره و فعالیتهای روزانه گزینهای ایمنتر محسوب میشود.
نحوه عملکرد تلفست (مکانیسم اثر)
فکسوفنادین (تلفست) یک آنتیهیستامین نسل دوم است که با مهار گیرندههای H1 هیستامینی در بدن عمل میکند. هیستامین مادهای است که هنگام بروز واکنش آلرژیک از سلولهای بدن آزاد میشود و باعث خارش، تورم، آبریزش بینی، عطسه و قرمزی چشمها میشود.
با مصرف تلفست، اثر هیستامین در محلهای حساس بدن مسدود میشود و در نتیجه واکنشهای آلرژیک کاهش یافته و علائم ناخوشایند کم میشوند. برخلاف آنتیهیستامینهای نسل اول، فکسوفنادین به سیستم عصبی مرکزی راه نمییابد و بنابراین خوابآلودگی کمتری ایجاد میکند.
به عبارت دیگر، تلفست بهطور هدفمند روی علائم آلرژی ناشی از هیستامین تأثیر میگذارد، بدون اینکه عملکرد روزمره فرد، تمرکز یا هوشیاری او را مختل کند.
چقدر طول میکشد تا تلفست عمل کند؟
اثر تلفست معمولاً ظرف ۱ ساعت پس از مصرف شروع میشود و اثر تسکین علائم آلرژی برای حدود ۲۴ ساعت باقی میماند.
نحوه جذب و دفع دارو در بدن تلفست (فارماکوکینتیک)
پس از مصرف خوراکی، فکسوفنادین(تلفست) بهسرعت جذب میشود و بیشترین غلظت پلاسمایی آن معمولاً در حدود ۱ تا ۳ ساعت پس از مصرف مشاهده میشود. این دارو عمدتاً از طریق مدفوع و مقدار کمتری از طریق ادرار دفع میشود و متابولیسم آن در کبد نسبتاً کم است، به همین دلیل اثرات دارو طولانی و پایدار باقی میماند. دانستن این اطلاعات به پزشکان و بیماران کمک میکند تا زمانبندی دقیق مصرف دارو و دوز مناسب را رعایت کنند و اثربخشی تلفست در کنترل علائم آلرژی حفظ شود.
خطرات و عوارض تلفست
تلفست بهعنوان یک آنتیهیستامین نسل دوم معمولاً ایمن در نظر گرفته میشود، اما ممکن است در برخی افراد عوارض خفیفی ایجاد کند. از جمله شایعترین موارد میتوان به خوابآلودگی خفیف، سردرد، تهوع یا ناراحتی معده اشاره کرد. این عوارض معمولاً کوتاهمدت و گذرا هستند و با ادامه مصرف کاهش مییابند. در موارد نادر، حساسیت شدید به ترکیبات دارو ممکن است باعث تورم لب، زبان یا بثورات پوستی شود که در این صورت مراجعه فوری به بیمارستان ضروری است.
| عوارض جانبی | شرح عوارض |
| واکنشهای آلرژیک یا آنژیوادم | این واکنشها شامل بثورات پوستی، خارش، کهیر، تورم صورت، چشمها، لبها، زبان، بازوها یا پاها و مشکلات در بلع یا تنفس است. |
| سرفه | این عارضه ممکن است در برخی بیماران مشاهده شود و اگر ادامهدار شد، باید با پزشک خود مشورت کنید. |
| خوابآلودگی و سرگیجه | برخی از افراد ممکن است بعد از مصرف دارو احساس خوابآلودگی و سرگیجه کنند. این عارضه معمولاً خفیف است. |
| خشکی دهان | در برخی از بیماران، ممکن است پس از مصرف دارو احساس خشکی در دهان رخ دهد. در صورت ادامه دار بودن این عارضه، با پزشک ارتباط بگیرید. |
| سردرد | سردرد یکی دیگر از عوارض شایع این دارو است که توسط برخی بیماران گزارش شده. در صورت بروز سردرد شدید یا مداوم، باید این مشکل را به پزشک اطلاع دهید. |
| اسهال | خروج مکرر و آبکی مدفوع که میتواند ناشی از تحریک معده یا روده باشد. |
| استفراغ | احساس نیاز به خارج کردن محتویات معده که میتواند به دلایل مختلفی از جمله تحریک گوارشی ایجاد شود. |
| ناراحتی معده | برخی از افراد بعد از مصرف این دارو ممکن است دچار ناراحتی معده شوند. در صورت شدید شدن معده درد، با پزشک تماس بگیرید. |
| گرفتگی صدا | کاهش یا تغییر صدا به دلیل التهاب حنجره یا مشکلات تنفسی. |
| تورم صورت، گلو، زبان، لبها، چشمها، دستها، پاها، مچ پا یا پایین ساق پا | افزایش حجم بافت نواحی مختلف بدن و تورم که میتواند ناشی از واکنش آلرژیک باشد. |
| مشکل در تنفس یا بلع | دشواری در تنفس یا بلع که میتواند علامت واکنش آلرژیک شدید باشد. |
| درد در بازوها، پاها یا کمر | احساس درد در نواحی مختلف بدن که ممکن است ناشی از تنش عضلانی یا التهاب باشد. |
خطرات مرتبط با مصرف طولانیمدت تلفست
تحقیقات نشان میدهد که مصرف طولانیمدت دوزهای توصیهشده فکسوفنادین معمولاً عوارض جدی ایجاد نمیکند. با این حال، استفاده مداوم بدون نظارت پزشک ممکن است مشکلاتی مانند اختلالات گوارشی خفیف یا سردرد مزمن را افزایش دهد. بنابراین بهتر است طول مدت مصرف با توجه به شدت آلرژی و نظر پزشک تعیین شود و مصرف خودسرانه طولانیمدت اجتناب کنید.
منع مصرف تلفست
افرادی که به ترکیبات فکسوفنادین یا سایر آنتیهیستامینهای نسل دوم حساسیت دارند، نباید تلفست مصرف کنند. همچنین بیماران مبتلا به نارسایی شدید کلیوی یا کبدی باید تحت نظر پزشک باشند و ممکن است نیاز به تنظیم دوز یا جایگزینی دارو باشد. در صورتی که فرد دچار واکنشهای آلرژیک شدید یا بیماریهای همزمان قلبی و فشارخون است، مشاوره پزشکی پیش از مصرف ضروری است.

آیا مصرف داروی تلفست در شیردهی و بارداری مجاز است؟
مطالعات محدود نشان میدهد که مصرف فکسوفنادین در بارداری معمولاً ایمن است، اما بهتر است در سه ماهه اول با به خاطر اینکه اندام نوزاد شکل میگیرد و در دوران شیردهی، مقدار کمی از دارو به شیر مادر منتقل میشود، بهتر است از مصرف آن خودداری کنید ولی به این نکته توجه کنید که در صورت مصرف پزشک باید میزان و زمان مصرف را تعیین کند تا اثرات دارو بر نوزاد به حداقل برسد.
تلفست برای بیماران کبدی ضرر دارد؟
فکسوفنادین عمدتاً بدون متابولیسم گسترده کبدی دفع میشود، اما در بیماران با اختلال شدید کبدی ممکن است غلظت دارو در خون افزایش یافته و عوارض جانبی شدت یابد. به همین دلیل، این افراد باید دوز مصرفی تلفست را با پزشک تنظیم کنند و مراقبت بیشتری داشته باشند تا هم اثر دارو حفظ شود و هم خطر بروز عوارض کاهش یابد.
لطفا توجه کنید که این مقاله رو برای مصرف کردن یا نکردن فکسوفنادین در نظر نگیرید و حتماً با پزشک متخصص مشورت کنید…
تداخلات دارویی تلفست
تلفست یا فکسوفنادین معمولاً با این موارد تداخل دارد.
| نوع دارو | تأثیر تداخل | توصیهها |
|---|---|---|
| آنتیاسیدها (حاوی آلومینیوم یا منیزیم) | کاهش جذب تلفست و کاهش اثرگذاری آن. | مصرف تلفست حداقل 2 ساعت قبل یا 4 ساعت بعد از آنتیاسیدها توصیه میشود. |
| کتوکونازول و اریترومایسین | افزایش سطح پلاسمایی تلفست به دلیل کاهش متابولیسم دارو در کبد. | این تداخل معمولاً خطرناک نیست، اما باید با پزشک مشورت شود. |
| داروهای حاوی گریپفروت | کاهش اثربخشی تلفست به دلیل تداخل با متابولیسم آن. | از مصرف آب گریپفروت یا فرآوردههای حاوی آن هنگام مصرف تلفست خودداری کنید. |
| داروهای آرامبخش (مثل بنزودیازپینها) | ممکن است خوابآوری یا عوارض جانبی داروهای آرامبخش را تشدید کند. | احتیاط در مصرف همزمان و مشورت با پزشک ضروری است. |
| مهارکنندههای MAO (مثل فنلزین) | ممکن است اثرات سیستم عصبی مرکزی را افزایش دهد. | مصرف همزمان توصیه نمیشود. |
| الکل | تشدید خوابآوری یا عوارض جانبی سیستم عصبی. | از مصرف الکل همراه با تلفست خودداری کنید. |
سیتریزین یا تلفست
طبق گزارش pubmed مطالعات بالینی نشان دادهاند که سیتریزین و فکسوفنادین هر دو در درمان علائم رینیت آلرژیک فصلی مؤثر هستند. یک مطالعه نشان داد که سیتریزین در کاهش علائم در ۱۲ ساعت اول پس از مصرف، ۲۶٪ مؤثرتر از فکسوفنادین بود و در کاهش کلی علائم نیز ۱۴٪ برتری داشت.با این حال، فکسوفنادین نسبت به سیتریزین احتمال کمتری برای ایجاد خوابآلودگی دارد و برای افرادی که نیاز به هوشیاری بالا دارند، گزینه بهتری است.
| ویژگی | سیتریزین | تلفست (فکسوفنادین) |
|---|---|---|
| نسل | نسل دوم | نسل دوم |
| احتمال خوابآلودگی | متوسط | کم |
| شروع اثر | حدود ۳۰–۶۰ دقیقه | حدود ۱ ساعت |
| مدت زمان اثر | حدود ۲۴ ساعت | حدود ۲۴ ساعت |
| مناسب کودکان | بزرگسالان و کودکان بالای ۶ سال | زیر 12 سال توصیه نمیشود. |
| قیمت تقریبی | معمولاً کمتر از تلفست | معمولاً کمی بالاتر از سیتریزین |
تفاوت فکسوفنادین با مونته لوکاست
همان طور که گفتیم، فکسوفنادین یک آنتیهیستامین نسل دوم است که با مسدود کردن گیرندههای H₁ هیستامین، از بروز علائم آلرژی مانند عطسه، آبریزش بینی و کهیر جلوگیری میکند. این دارو بهسرعت جذب میشود و اثرات آن معمولاً ظرف ۱ ساعت شروع میشود و تا ۲۴ ساعت ادامه دارد. مطالعات نشان دادهاند که فکسوفنادین در کاهش علائم آلرژی مؤثرتر از مونتهلوکاست است.
در مقابل، مونتهلوکاست یک آنتاگونیست گیرنده لوکوترین است که با مسدود کردن اثرات لوکوترینها، از التهاب مجاری تنفسی جلوگیری میکند. این دارو بیشتر در درمان آسم و رینیت آلرژیک مزمن کاربرد دارد و اثرات آن معمولاً پس از چند روز مصرف منظم ظاهر میشود. مطالعات نشان دادهاند که ترکیب مونتهلوکاست با آنتیهیستامینها میتواند کنترل بهتری بر علائم آلرژی داشته باشد.
| ویژگی | فکسوفنادین (تلفست) | مونتهلوکاست |
|---|---|---|
| نوع دارو | آنتیهیستامین نسل دوم | آنتاگونیست گیرنده لوکوترین |
| مکانیزم اثر | مسدودکننده گیرندههای H₁ هیستامین | مسدودکننده اثرات لوکوترینها |
| شروع اثر | حدود ۱ ساعت | چند روز مصرف منظم |
| مدت زمان اثر | حدود ۲۴ ساعت | متغیر، بستگی به مصرف منظم |
| کاربرد اصلی | رینیت آلرژیک فصلی، کهیر | آسم، رینیت آلرژیک مزمن |
| احتمال خوابآلودگی | کم | کم |
| مناسب برای کودکان | بله، از 12 سال به بالا | بله، از ۲ سال به بالا |
| عوارض جانبی شایع | سردرد، تهوع، سرگیجه | سردرد، درد شکمی، سرفه |
| قیمت تقریبی | متوسط | متوسط |
چند بار در طول این مطلب تاکید کردیم که شرایط هر فرد با فرد دیگری متفاوت است پس لطفا قبل از استفاده از هر دارویی با پزشک مشورت کنید.
قرص تلفست قیمت نهایی؛ جمعبندی قیمتها
در جدول زیر قیمتهای حدودی تلفست (ایرانی و خارجی) رو براتون دستهبندی کردم. البته قیمت ها مربوط به زمان نوشتن این مطلب میباشد.
| نوع | دوز | قیمت تقریبی (هزار تومان) | برندهای رایج |
|---|---|---|---|
| خارجی | ۶۰mg | ۳۵۰ – ۴۵۰ | Sanofi, Aventis |
| خارجی | ۱۸۰mg | ۴۵۰ – ۶۰۰ | Telfast, Allegra |
| ایرانی | ۶۰mg | ۹۰ – ۱۴۰ | عبیدی، زهراوی |
| ایرانی | ۱۸۰mg | ۱۳۰ – ۱۸۰ | عبیدی، زهراوی |
| وارداتی خاص | ۱۲۰mg | ۳۰۰ – ۴۵۰ | فقط بعضی داروخانهها |
قیمت قرص تلفست ایرانی
قرص تلفست ایرانی یکی از داروهای موثر در درمان آلرژی است و برای افراد در شرایط مختلف تجویز میشود. این دارو نسبت به نسخههای خارجی خود قیمت مناسبتری دارد، اما از نظر کیفیت تفاوت قابل توجهی با آنها ندارد. تلفست ایرانی بهراحتی در داروخانهها در دسترس است و میتواند به کنترل علائم آلرژی مانند عطسه، آبریزش بینی، سرفه و گرفتگی بینی کمک کند. همچنین، این دارو در کاهش علائم اگزما و سایر حساسیتهای پوستی نیز موثر است.
حساسیت یکی از بیماریهای شایع است که بسیاری از افراد را تحت تأثیر قرار میدهد. کنترل علائم آلرژی معمولاً با استفاده از داروهای ضد حساسیت مانند تلفست ممکن میشود. گرچه برخی از این داروها بدون نسخه قابل تهیه هستند، اما بهترین روش استفاده، مصرف تحت نظر پزشک است تا بر اساس شدت آلرژی، داروی مناسب و دوز دقیق تعیین شود. برای اطلاع از قیمت قرص تلفست ایرانی میتوانید به داروخانههای اینترنتی مراجعه کرده یا از داروخانههای سطح شهر استعلام بگیرید.





