عدد اتمی چیست؟
امروز در این مطلب از نشریه شیمی شیمی داکس قصد داریم راجب عدد اتمی عناصر صحبت کنیم البته شماها احتمالاً با عدد اتمی در علوم هشتم آشنا شدید، ولی قول میدهم خواندن این مقاله هم خالی از لطف نیست و این مفهوم را از زوایای جدیدی بررسی کنیم. بیایید تا ابتدا به این سوال که عدد اتمی نشان دهنده چیست؟ پاسخ بدهیم.
عدد اتمی چیست؟
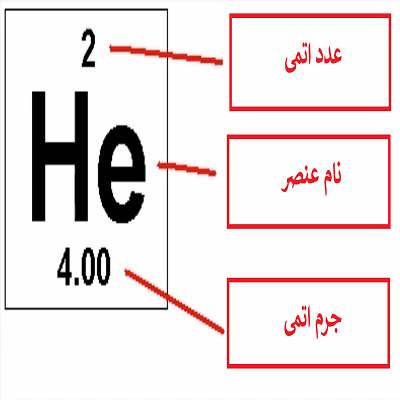
عدد پروتون یا همان عدد اتمی(Atomic number) که با نماد Z هم نشان داده میشود، در واقع تعداد پروتونهای موجود در هسته یک اتم است. این عدد بسیار مهم است چون هویت هر عنصر را مشخص میکند؛ بهعنوان مثال اگر اتمی ۶ پروتون داشته باشد، بدون شک آن عنصر کربن است و اگر ۸ پروتون داشته باشد، آن عنصر اکسیژن خواهد بود یا مثلاً عدد اتمی کلر 17 هست..
زمانی که من در علوم هشتم با مفهوم عدد اتمی آشنا شدم، این سوال و پرسش برای من ایجاد شد که چرا عدد اتمی را با نماد Z نشان می دهند؟ در پاسخ به این پرسش باید بگم که نماد متعارف Z از کلمهای آلمانی به نام Zahl به معنای عدد گرفته شده است.
بد نیست بدانید که فرمول عدد اتمی به این مطلب اشاره دارد که تعداد پروتونها و در حالت عادی با تعداد الکترونها هم مساوی می باشد.
عنصر چیست؟
در تعریف بالا از یک واژه بنام عنصر استفاده کردیم. عنصر در واقع سادهترین مادهی شیمیایی است که فقط از یک نوع اتم تشکیل شده و با روشهای معمول شیمیایی به مادهای سادهتر تجزیه نمیشود. مثلاً اکسیژن، کربن و آهن هرکدام یک عنصر محسوب میشوند. هر عنصر ویژگیها و خواص مخصوص به خود را دارد که آن را از سایر عناصر متمایز میکند.

اگر به مفهوم عنصر علاقهمند هستید، میتوانید مقاله عنصر چیست و چه تفاوتی با ترکیب دارد؟ را که قبلاً توسط بهروز زرقانی نوشته شده است را بخوانید.
تاریخچه و روند کشف عدد اتمی
جالبه بدانید که دمیتری مندلیف در سال ۱۸۶۹ اولین جدول تناوبی را بر اساس وزن اتمی منتشر کرد. او برای هماهنگی بیشتر، بعضی عناصر مانند تلوریم و ید را برخلاف ترتیب وزن اتمی جابهجا کرد تا با خواص شیمیایی آنها مطابقت داشته باشد.(بعدها مشخص شد که این جابهجاییها در واقع با روش مدرن امروزی ــ یعنی مرتبسازی عناصر بر اساس عدد اتمی ــ همخوانی دارد) مشکل اصلی جدول اولیه این بود که برخی عناصر مثل کبالت، آرگون، پتاسیم و نیکل وزن اتمی نزدیک و حتی معکوس داشتند و ما جای درست آنها را تنها با توجه به خواص شیمیایی، میتوانیم مشخص کنیم.
گام مهم بعدی در اوایل قرن بیستم برداشته شد؛ جایی که ارنست رادرفورد در سال ۱۹۱۱ نشان داد بیشتر جرم اتم در هسته متمرکز است و بار هسته نقشی کلیدی در ساختار آن دارد. اندکی بعد، آنتونیوس ون دن بروک پیشنهاد کرد که جایگاه عناصر در جدول تناوبی بر اساس تعداد بارهای مثبت هسته یا همان عدد اتمی Z تعیین شود. این فرضیه توسط هنری موزلی در سال ۱۹۱۳ با آزمایش پرتو ایکس تأیید شد. هنری موزلی تونست ثابت کنه که خواص شیمیایی عناصر به بار هسته وابسته است.
سرانجام با کشف نوترون توسط جیمز چادویک در سال ۱۹۳۲، تصویر کاملتری از ساختار هسته اتم به دست آمد. از آن زمان به بعد عدد اتمی بهعنوان تعداد پروتونهای موجود در هسته تعریف شد و مبنای نهایی طبقهبندی عناصر قرار گرفت. جالبه بانید که این کشف نهتنها ابهامات جدول تناوبی مندلیف را برطرف کرد بلکه راه را برای شناخت ایزوتوپها و درک بهتر خواص شیمیایی و فیزیکی عناصر هموار ساخت.
در واقع تفاوت بین عناصر مختلف در تعداد پروتونهای هسته آنهاست، نه در جرم یا تعداد نوترونها…بنابراین عدد اتمی کلید اصلی برای تشخیص و طبقهبندی عناصر در جدول تناوبی به شمار میرود.
مفاهیم وابسته به عدد اتمی
خب ما در بررسی معنا و مفهوم عدد اتمی با مفاهیمی مواجه می شویم که اگر اجازه بدهید قبل از اینکه ادامه این مطلب بنویسم یه تعریف ساده ای از این مفاهیم انجام خواهیم داد.
مواد شیمیایی چیست؟
ماده شیمیایی یا مواد شیمیایی (Chemical Substance) به هر مادهای گفته میشود که ترکیب مشخص و خواص فیزیکی و شیمیایی ثابتی دارد.
ایزوتوپ چیست؟
ایزوتوپها اتمهایی از یک عنصر هستند که عدد اتمی یکسان (یعنی تعداد پروتونهای برابر) دارند اما تعداد نوترونهایشان متفاوت است. به همین دلیل، خواص شیمیایی ایزوتوپهای یک عنصر تقریباً مشابه است، اما جرم آنها فرق میکند.
برای مثال، عنصر کربن سه ایزوتوپ معروف دارد: کربن-۱۲ و کربن-۱۳ که پایدار هستند، و کربن-۱۴ که رادیواکتیو است و در تعیین قدمت آثار باستانی (روش کربنسنجی) استفاده میشود.
انواع ایزوتوپ
ما بصورت کلی دو دسته ایزوتوپ داریم.
- ایزوتوپ پایدار: این ایزوتوپها هستهشان پایدار است و دچار واپاشی هستهای نمیشوند. بیشتر عناصر موجود در طبیعت ایزوتوپهای پایدار دارند. مثلاً کربن-۱۲ و کربن-۱۳ ایزوتوپهای پایدار کربن هستند.
- ایزوتوپ رادیواکتیو: این نوع ایزوتوپها هسته ناپایداری دارند و با گذشت زمان واپاشی کرده و به عناصر دیگر تبدیل میشوند. در این فرآیند معمولاً پرتوهای آلفا، بتا یا گاما آزاد میکنند. مثلاً کربن-۱۴ یک ایزوتوپ رادیواکتیو است که در روش کربنسنجی کاربرد دارد.
اگر بخواهم ساده بگم در اولی عنصر ثابت و تغییر نمیکند ولی در دومی به مرور زمان ما شاهد تغییرات و واپاشی هستیم.
| نوع ایزوتوپ | ویژگی | مثال | کاربرد |
|---|---|---|---|
| ایزوتوپ پایدار | هسته تغییر نمیکند و عنصر ثابت میماند | کربن-12، اکسیژن-16 | در مواد طبیعی و زیستشناسی |
| ایزوتوپ رادیواکتیو | هسته ناپایدار است و با گذشت زمان واپاشی میکند | کربن-14، اورانیوم-235 | پزشکی هستهای، تولید انرژی، کربنسنجی |
نماد شیمیایی چیست؟
نماد شیمیایی(Chemical symbol) در واقع نشانهای کوتاه و جهانی برای شناسایی عناصر مختلف است. همان طور که میدانید، هر عنصر در جدول تناوبی یک نماد ویژه دارد که معمولاً از حروف اول نام لاتین یا انگلیسی آن گرفته شده است.
چگالی چیست؟
چگالی به زبان ساده یعنی مقدار جرم یک ماده در حجم مشخص. فرمولش هم خیلی راحته:
چگالی = حجم/ جرم
یعنی اگر یک جسم سنگینتر باشد ولی فضای کمی اشغال کند، چگالی بالایی دارد (آهن). اما اگر جرم کمی داشته باشد و حجم زیادی بگیرد، چگالی پایینی خواهد داشت (پنبه). چگالی واحدهای مختلفی دارد، اما رایجترین آن در علوم پایه گرم بر سانتیمتر مکعب (g/cm³) است.
وزن اتمی چیست؟
وزن اتمی یا جرم اتمی نسبی، میانگین جرم اتمهای یک عنصر است که بر اساس نسبت ایزوتوپهای آن عنصر در طبیعت محاسبه میشود. چون بیشتر عناصر چند ایزوتوپ دارند (مثلاً کلر با ایزوتوپهای ۳۵ و ۳۷)، وزن اتمی آنها یک عدد ثابت صحیح نیست، بلکه یک عدد اعشاری است. این مقدار بدون واحد بوده و نشان میدهد اتم یک عنصر چند برابر سنگینتر از یکدوازدهم جرم اتم کربن-۱۲ است.
جرم اتم چیست؟
جرم اتم در واقع وزن یک اتم است که بیشتر آن مربوط به مجموع جرم پروتونها و نوترونهای موجود در هسته میباشد. چون جرم الکترونها خیلی کم است، معمولاً نادیده گرفته میشود. جرم اتمی هر عنصر معمولاً بر حسب یکای جرم اتمی (amu) بیان میشود و عددی نزدیک به عدد جرمی آن عنصر است.
مقدار جرم اتم = پروتون + نوترون
اگر یکم گیج شدید اصلاً جای نگرانی نیست و این جدول به شما کمک میکند!!!
| مفهوم | نماد | تعریف ساده | مثال |
|---|---|---|---|
| عدد اتمی | Z | تعداد پروتونهای موجود در هستهٔ یک اتم | کربن → Z = 6 |
| عدد جرمی | A | مجموع پروتونها و نوترونها در هسته | کربن-12 → A = 12 |
| جرم اتمی | – | جرم واقعی یک اتم بر حسب amu | کربن-12 = 12 amu |
| وزن اتمی | – | میانگین جرم ایزوتوپهای یک عنصر در طبیعت | کلر ≈ 35.5 |
مسائل عدد جرمی و عدد اتمی
در ادامه به حل یک نمونه سوال عدد جرمی و عدد اتمی میپردازیم.
یک اتم دارای عدد اتمی 17 و عدد جرمی 37 است.
- تعداد پروتونهای موجود را تعیین کنید.
- تعداد نوترونهای موجود را تعیین کنید.
- تعداد الکترونهای موجود را تعیین کنید.
در جواب قسمت اول سوال باید بگم که: عدد اتمی همیشه برابر با تعداد پروتونهاست پس پروتون برابر با 17 هست. برای سوال دوم همان طور که گفتیم،
Z – A = تعداد نوترون
پس نوترون برابرست با 20 می باشد. برای قسمت سوم سوال هم باید بگم که در اتم خنثی، تعداد پروتونها و الکترونها برابر است.
عدد اتمی و گازهای نجیب
برخی گروههای جدول تناوبی از نظر ویژگیهای شیمیایی و فیزیکی بسیار شبیه به هم هستند. برای نمونه، گازهای هلیم (He)، نئون (Ne)، آرگون (Ar)، کریپتون (Kr)، زنون (Xe) و رادون (Rn) همگی بیرنگ بوده و واکنشپذیری بسیار کمی دارند. به همین دلیل به آنها گازهای نجیب میگویند. عدد اتمی این عناصر به ترتیب ۲، ۱۰، ۱۸، ۳۶، ۵۴ و ۸۶ است.
عدد اتمی و فلزات قلیایی
گروه دیگری از عناصر شامل فلزات نرم و بسیار واکنشپذیر هستند که با نام فلزات قلیایی شناخته میشوند. این عناصر شامل لیتیم (Li)، سدیم (Na)، پتاسیم (K)، روبیدیم (Rb)، سزیم (Cs) و فرانسیم (Fr) میشوند. عدد اتمی آنها نیز به ترتیب ۳، ۱۱، ۱۹، ۳۷، ۵۵ و ۸۷ است.
قانون تناوبی و جدول تناوبی
اگر اعداد اتمی عناصر در گروههای گازهای نجیب و فلزات قلیایی را مقایسه کنیم، مشاهده میکنیم که وقتی عناصر را بر اساس افزایش عدد اتمی مرتب میکنیم، بعد از هر گاز نجیب معمولاً یک فلز قلیایی قرار میگیرد. بررسی سایر گروههای جدول تناوبی نیز نشان میدهد که با این ترتیب، خواص عناصر یک الگوی تکراری و قابل پیشبینی دارند.
قانون تناوبی بیان میکند که وقتی عناصر به ترتیب افزایش عدد اتمی بررسی شوند، شباهتهای شیمیایی و فیزیکی آنها به صورت تناوبی تکرار میشود. جدول تناوبی بر اساس این قانون طراحی شده است و طوری چیده شده که عناصر با خواص مشابه در یک گروه قرار گیرند. با نگاه کردن به جایگاه یک عنصر در جدول، میتوان بسیاری از خواص آن را پیشبینی کرد.
| ویژگی | گازهای نجیب | فلزات قلیایی |
|---|---|---|
| عناصر و عدد اتمی | هلیم (He, 2)، نئون (Ne, 10)، آرگون (Ar, 18)، کریپتون (Kr, 36)، زنون (Xe, 54)، رادون (Rn, 86) | لیتیم (Li, 3)، سدیم (Na, 11)، پتاسیم (K, 19)، روبیدیم (Rb, 37)، سزیم (Cs, 55)، فرانسیم (Fr, 87) |
| رنگ | بیرنگ | فلز براق (نقرهای) |
| واکنشپذیری | کم | زیاد |
| حالت فیزیکی | گاز | فلز نرم |





